Với kết quả 88,94% đại biểu tham gia biểu quyết tán thành thông qua, Luật sửa đổi, bổ sung một số điều của Luật Dược đã chính thức được thông qua tại kỳ họp thứ 8, Quốc hội khóa XV.
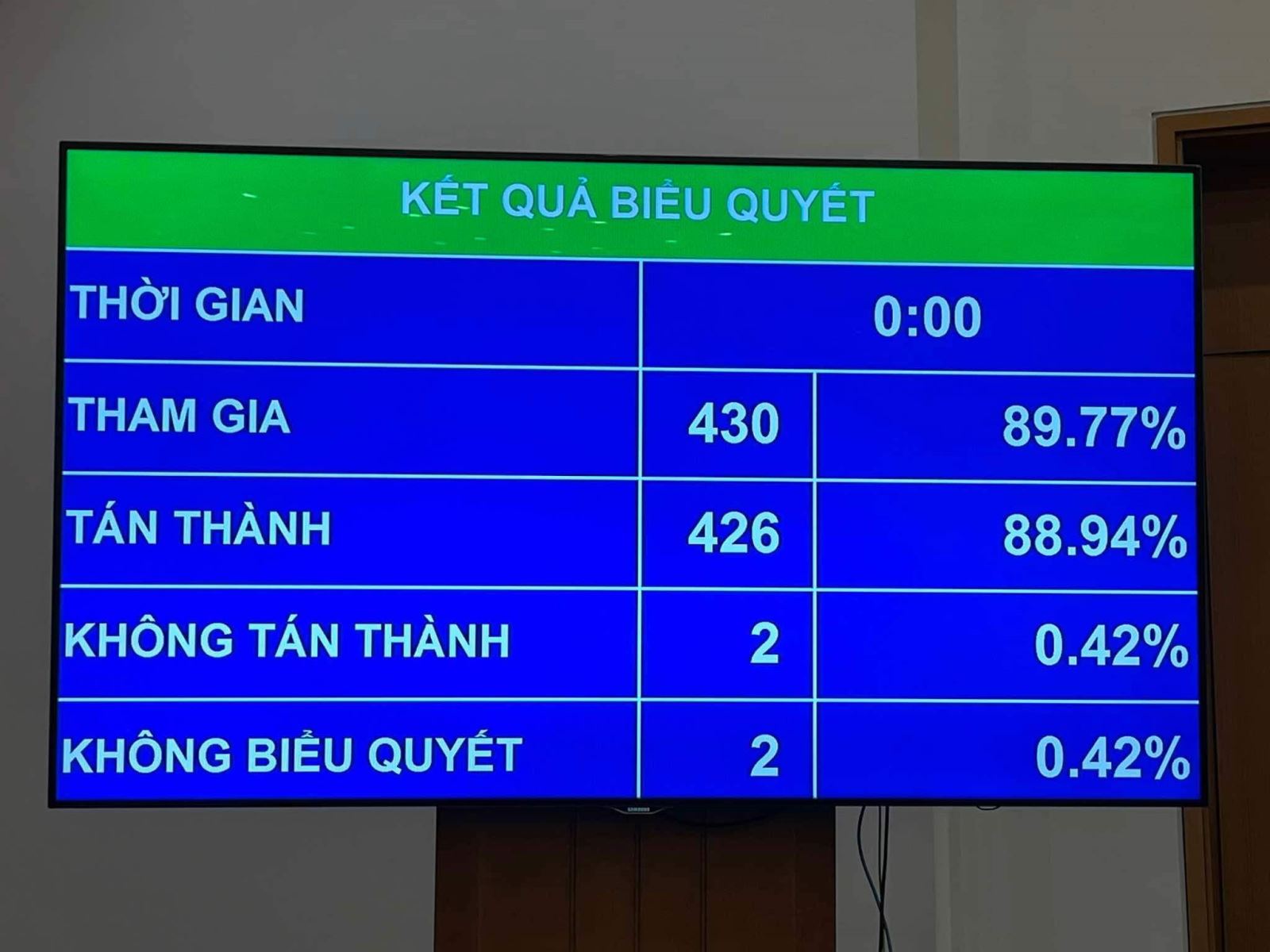 Kết quả biểu quyết thông qua Luật Dược sửa đổi tại kỳ họp thứ 8, Quốc hội khóa XV. (Ảnh: TTXVN)
Kết quả biểu quyết thông qua Luật Dược sửa đổi tại kỳ họp thứ 8, Quốc hội khóa XV. (Ảnh: TTXVN)Trước khi các đại biểu Quốc hội biểu quyết thông qua toàn bộ dự thảo Luật sửa đổi, bổ sung một số điều của Luật Dược, Quốc hội đã tiến hành biểu quyết để thông qua 2 nội dung của Luật gồm:
Đối với khoản 23 Điều 1 về quyền và trách nhiệm của các cơ sở tổ chức chuỗi nhà thuốc, các nhà thuốc trong chuỗi nhà thuốc. Kết quả biểu quyết có 89,14% đại biểu tham gia tán thành.
Lấy biểu quyết với khoản 30 Điều 1 về thẩm quyền, hồ sơ, thủ tục, thời gian cấp, gia hạn của giấy đăng ký lưu hành thuốc, nguyên liệu làm thuốc. Kết quả biểu quyết có 86,22% đại biểu tán thành.
Trước khi biểu quyết, bà Nguyễn Thúy Anh, Chủ nhiệm Ủy ban Xã hội của Quốc hội đã đọc báo cáo tiếp thu, giải trình và chỉnh lý dự thảo Luật sửa đổi, bổ sung một số điều của Luật Dược.
Cụ thể, về chính sách của Nhà nước về dược và phát triển công nghiệp dược (Điều 7 và Điều 8 (sửa đổi), tiếp thu ý kiến đại biểu, Ủy ban Thường vụ Quốc hội đã chỉ đạo rà soát Điều 7 (sửa đổi) để bảo đảm thể hiện nội dung lớn mang tính nguyên tắc; bổ sung quy định “Có chính sách kiểm soát số lượng giấy đăng ký lưu hành thuốc đối với các thuốc có cùng dược chất, dược liệu phù hợp với điều kiện kinh tế - xã hội trong từng thời kỳ” tại khoản 14 và “Ưu tiên đầu tư phát triển hạ tầng công nghệ thông tin, thực hiện chuyển đổi số trong các hoạt động về dược” tại khoản 15. Tuy nhiên, để chính sách đi vào cuộc sống, nhất là quy định tại khoản 8, 13, 14, Ủy ban Thường vụ Quốc hội xin phép vẫn giao Chính phủ quy định chi tiết Điều này.
Liên quan đến chính sách ưu đãi, hỗ trợ đầu tư trong phát triển công nghiệp được, trên cơ sở ý kiến của đa số đại biểu phát biểu, Ủy ban Thường vụ Quốc hội thống nhất với Chính phủ dự kiến tiếp thu khoản 1 Điều 8 theo Phương án 1, đó là, cho phép áp dụng ưu đãi, hỗ trợ đầu tư đặc biệt với dự án thành lập mới trong lĩnh vực dược có tổng vốn đầu tư từ 3.000 tỷ đồng trở lên, thực hiện giải ngân tối thiểu 1.000 tỷ đồng trong thời hạn 3 năm kể từ ngày được cấp Giấy chứng nhận đăng ký đầu tư hoặc chấp thuận chủ trương đầu tư. Đồng thời, để bảo đảm đồng bộ chính sách ưu đãi, hỗ trợ đầu tư đặc biệt trong lĩnh vực dược, Ủy ban Thường vụ Quốc hội đề nghị Chính phủ chỉ đạo quan tâm thể hiện các nội dung ưu đãi thuế khi sửa đổi pháp luật về thuế và pháp luật có liên quan, trong đó có dự án Luật Thuế thu nhập doanh nghiệp (sửa đổi).
Về kinh doanh chuỗi nhà thuốc (Điều 17a (bổ sung); các điều 31, 32, 33, 36, 37 và 38 (sửa đổi); Điều 47a (bổ sung); trên cơ sở ý kiến của đại biểu, Ủy ban Thường vụ Quốc hội đã rà soát, chỉnh lý tại các điều quy định về chuỗi nhà thuốc; trong đó, có nội dung giao Bộ trưởng Bộ Y tế quy định việc luân chuyển người chịu trách nhiệm chuyên môn về dược giữa các nhà thuốc trong chuỗi như thể hiện tại điểm g khoản 2 Điều 47a (bổ sung); quy định trách nhiệm của nhà thuốc trong chuỗi phải tạm dừng hoạt động trong trường hợp cơ sở tổ chức chuỗi nhà thuốc tạm dừng hoạt động từ 6 tháng trở lên (điểm d khoản 4 Điều 47a (bổ sung), chấm dứt hoạt động khi cơ sở tổ chức chuỗi nhà thuốc chấm dứt hoạt động (điểm đ khoản 4 Điều 47a (bổ sung).
Về kinh doanh thuốc, nguyên liệu làm thuốc theo phương thức thương mại điện tử (các điều 6, 32 và 42 (sửa đổi)); trên cơ sở ý kiến đại biểu, để bảo đảm quản lý kịp thời những tình huống có thể phát sinh trên thực tế, ngoài quyền và trách nhiệm đã được quy định tại dự thảo Luật, Ủy ban Thường vụ Quốc hội đã bổ sung 1 khoản quy định các cơ sở kinh doanh dược theo phương thức thương mại điện tử phải tuân thủ quy định của Chính phủ về bán buôn thuốc, nguyên liệu làm thuốc, bán lẻ thuốc theo phương thức thương mại điện tử tại điểm h khoản 4 Điều 42 (sửa đổi). Đồng thời, tổng hợp các quy định về quyền và trách nhiệm của cơ sở kinh doanh dược khi kinh doanh theo phương thức thương mại điện tử vào khoản 4 Điều 42 (sửa đổi).
Về cấp, gia hạn, thay đổi, bổ sung Giấy đăng ký lưu hành thuốc (Điều 56 (sửa đổi); thực hiện phương châm đổi mới tư duy trong xây dựng lập pháp, Ủy ban Thường vụ Quốc hội đã chỉnh lý nội dung sửa đổi tại Điều 56 theo hướng không quy định cụ thể trong Luật mà giao Bộ trưởng Bộ Y tế quy định chi tiết hồ sơ, thủ tục cấp, gia hạn, thay đổi, bổ sung giấy đăng ký lưu hành thuốc, nguyên liệu làm thuốc tại Điều 56.
Ngoài ra, tiếp thu ý kiến đại biểu đề nghị nghiên cứu bổ sung quy định nhằm hạn chế cấp mới giấy phép đăng ký lưu hành đối với các thuốc có sự trùng lặp, để hạn chế việc lợi dụng chính sách để “giữ chỗ” đăng ký cấp phép lưu hành do phí cấp phép thấp, trước mắt, khoản 7 Điều 56 (sửa đổi) quy định việc không tiếp tục gia hạn giấy đăng ký lưu hành đối với thuốc mà trong 5 năm không lưu hành trên thị trường. Đồng thời, tại khoản 14 Điều 7 (sửa đổi) quy định Nhà nước có chính sách kiểm soát số lượng giấy đăng ký lưu hành thuốc đối với các thuốc có cùng dược chất, dược liệu và giao Chính phủ quy định chi tiết.
Về quản lý giá thuốc (giải thích từ ngữ tại các khoản 44, 45, 46 và 47 Điều 2 (sửa đổi); các điều 107, 109, 110, 112 và 113 (sửa đổi); bãi bỏ Điều 114): Tiếp thu ý kiến đại biểu, Ủy ban Thường vụ Quốc hội đã rà soát và thống nhất với đề xuất của Chính phủ trong việc quy định biện pháp công bố giá bán buôn dự kiến áp dụng đối với thuốc kê đơn. Đây là biện pháp đặc thù trong quản lý giá thuốc do thuốc kê đơn chiếm tỷ lệ lớn trên thị trường, được sử dụng nhiều tại cơ sở y tế và người bệnh phải mua theo chỉ định của thầy thuốc. Bên cạnh đó, quy định Bộ Y tế kiến nghị về mức giá bán buôn thuốc dự kiến với cơ sở kinh doanh thuốc để hạn chế tăng giá thuốc qua mỗi tầng, nấc trung gian và đội giá lên cao khi đến tay người tiêu dùng. Đồng thời, giữ quy định hiện hành về thặng số bán lẻ tối đa đối với thuốc bán tại cơ sở bán lẻ thuốc trong khuôn viên cơ sở khám bệnh, chữa bệnh.
Liên quan đến kiến nghị của đại biểu về biện pháp kê khai giá, do nội dung này được thực hiện theo pháp luật về giá, Ủy ban Thường vụ Quốc hội đề nghị Chính phủ rà soát các văn bản hướng dẫn, quy định chi tiết Luật Giá năm 2023 để bổ sung quy định về tiêu chí lựa chọn danh sách các cơ sở phải kê khai giá, bảo đảm thực hiện thống nhất, minh bạch tại các địa phương; đồng thời, theo dõi sát sao khâu tổ chức thực hiện, kịp thời phát hiện những khó khăn, vướng mắc để xử lý; đề nghị Bộ Y tế định kỳ cập nhật Danh mục thuốc thiết yếu để bảo đảm hướng dẫn đầy đủ theo quy định của pháp luật về giá.
Về điều khoản thi hành (Điều 3): Tiếp thu ý kiến đại biểu, Ủy ban Thường vụ Quốc hội đã chỉnh lý hiệu lực thi hành và điều khoản chuyển tiếp như thể hiện tại Điều 3 của dự thảo Luật, theo đó, quy định Luật có hiệu lực thi hành từ ngày 1/7/2025 (khoản 1 Điều 3) và chỉ áp dụng hiệu lực kể từ ngày 1/1/2025 đối với quy định về gia hạn giấy đăng ký lưu hành thuốc, nguyên liệu làm thuốc, quy định về bán buôn thuốc, nguyên liệu làm thuốc của cơ sở sản xuất, nhập khẩu, bán buôn thuốc (khoản 2 Điều 3) để khắc phục ngay khó khăn trong kinh doanh dược.
Các ý kiến của các vị đại biểu Quốc hội đã được nghiêm túc nghiên cứu, tiếp thu tối đa và chỉnh lý dự thảo Luật ở các nội dung cụ thể như: (i) khái niệm “thuốc không kê đơn”, “thuốc công nghệ cao”; (ii) quy định người chịu trách nhiệm chuyên môn về dược của cơ sở tổ chức chuỗi nhà thuốc phải có bằng dược sỹ và có 02 năm thực hành chuyên môn tại cơ sở dược phù hợp; (iii) bảo đảm tính minh bạch và thống nhất trong các quy địnhvề quyền của các cơ sở sản xuất, cơ sở xuất khẩu, nhập khẩu, cơ sở bán buôn thuốc, nguyên liệu làm thuốc, cơ sở kinh doanh dược có vốn đầu tư nước ngoài; (iv) cho phép cơ sở khám bệnh, chữa bệnh nhập khẩu thuốc chưa có giấy đăng ký lưu hành tại Việt Nam để phục vụ nhu cầu điều trị đặc biệt cho người bệnh của cơ sở tại điểm i khoản 2 Điều 60 và giao Chính phủ quy định chi tiết việc điều chuyển thuốc tại điểm d khoản 7 Điều 60; (v) giao Bộ trưởng Bộ Y tế quy định về hình thức, cách thức thông tin thuốc (thay vì Chính phủ như hiện hành) và chỉnh lý về từ ngữ, văn phong, kỹ thuật lập pháp ở hầu hết các điều, khoản của dự thảo Luật.
Dự thảo Luật sau khi chỉnh lý gồm 3 điều, trong đó Điều 1 sửa đổi 50 điều, bãi bỏ 2 điểm, 2 khoản và 1 điều của Luật Dược hiện hành, bổ sung 3 điều mới; Điều 2 sửa đổi, bổ sung Phụ lục số 01 ban hành kèm theo Luật Giá số 16/2023/QH15; Điều 3 về Điều khoản thi hành.
Các nội dung tiếp thu, giải trình và chỉnh lý được thể hiện cụ thể tại Báo cáo số 1062 với 06 nội dung lớn, 10 nội dung cụ thể và các nội dung khác.
So với Luật hiện hành, dự thảo Luật có 7 nhóm điểm mới cơ bản như sau:
Chính sách của Nhà nước về dược được tiếp tục hoàn thiện, thể chế hóa quan điểm của Đảng nhằm mục tiêu phát triển ngành công nghiệp dược Việt Nam thành ngành công nghiệp mũi nhọn. Theo đó, dự thảo Luật bổ sung một số quy định mang tính đột phá hơn so với Luật Dược năm 2016 để thu hút đầu tư và thúc đẩy hơn nữa việc nghiên cứu phát triển sản xuất thuốc, nguyên liệu làm thuốc như chính sách ưu tiên về các thủ tục hành chính khi cấp giấy đăng ký lưu hành, cấp phép nhập khẩu; chính sách áp dụng các cơ chế ưu đãi, hỗ trợ từ các quỹ hỗ trợ cho hoạt động khoa học và công nghệ trong nghiên cứu, phát triển, thử nghiệm lâm sàng, chuyển giao công nghệ, sản xuất thuốc, nguyên liệu làm thuốc; chính sách giữ giá, giảm giá đối với một số nhóm thuốc chuyển giao công nghệ sản xuất; chính sách chuyển đổi số trong các hoạt động về dược; xác định quy mô dự án thuộc lĩnh vực dược được áp dụng ưu đãi, hỗ trợ đầu tư đặc biệt và giao Chính phủ quy định chi tiết để bảo đảm tính khả thi, đưa các chính sách của Nhà nước về dược và phát triển công nghiệp dược đi vào cuộc sống.
Tạo hành lang pháp lý cho các hình thức, phương thức kinh doanh mới, đó là: (i) quy định cơ sở tổ chức chuỗi nhà thuốc là một loại hình cơ sở kinh doanh dược riêng biệt, điều kiện kinh doanh, quyền và trách nhiệm của cơ sở tổ chức chuỗi nhà thuốc, các nhà thuốc trong chuỗi nhà thuốc, nổi bật là quyền luân chuyển thuốc và quyền luân chuyển người chịu trách nhiệm chuyên môn về dược giữa các nhà thuốc trong chuỗi nhà thuốc; (ii) quy định về kinh doanh thuốc, nguyên liệu làm thuốc theo phương thức thương mại điện tử, cụ thể, bổ sung quy định phương tiện điện tử, loại thuốc, nguyên liệu làm thuốc được phép kinh doanh theo phương thức thương mại điện tử; bổ sung quyền, trách nhiệm của các cơ sở kinh doanh dược theo phương thức này.
Cụ thể hóa quyền và trách nhiệm của cơ sở kinh doanh dược có vốn đầu tư nước ngoài ngay trong Luật để bảo đảm tính công khai, minh bạch trong quản lý nhà nước.
Mở rộng quyền của cơ sở sản xuất, cơ sở xuất khẩu, nhập khẩu, cơ sở bán buôn thuốc, nguyên liệu làm thuốc trong việc bán trực tiếp cho một số cơ sở y tế, cơ sở cai nghiện ma túy, cơ sở kiểm nghiệm, cơ sở nghiên cứu, đào tạo và một số cơ sở khác; cho phép cơ sở khám bệnh, chữa bệnh nhập khẩu thuốc phục vụ nhu cầu điều trị đặc biệt của bệnh nhận tại cơ sở khám bệnh, chữa bệnh.
Đẩy mạnh cải cách thủ tục hành chính trong đăng ký lưu hành thuốc, nguyên liệu làm thuốc theo hướng phân loại các thuốc, nguyên liệu làm thuốc dựa trên các cấp độ khác nhau về tính chất của thuốc cũng như việc lưu hành để điều chỉnh hồ sơ, thủ tục, thời hạn cấp, gia hạn, thay đổi, bổ sung giấy đăng ký lưu hành thuốc, nguyên liệu làm thuốc tương ứng nhằm tăng khả năng sớm tiếp cận thuốc cho người dân mà vẫn đảm bảo hiệu lực quản lý nhà nước, kiểm soát chất lượng, an toàn và hiệu quả của thuốc; bổ sung quy định để hạn chế cấp số đăng ký lưu hành trùng lặp. Đồng thời, có quy định đặc thù về hồ sơ, thủ tục đăng ký thuốc, nguyên liệu làm thuốc, kiểm nghiệm thuốc và kinh doanh thuốc nói chung để đáp ứng yêu cầu quốc phòng, an ninh, thiên tai, thảm họa và dịch bệnh.
Bãi bỏ thủ tục xác nhận nội dung thông tin thuốc. Tăng cường phân cấp, phân quyền, phát huy vai trò của Sở Y tế trong thu hồi để kịp thời xử lý thuốc vi phạm chất lượng trên địa bàn quản lý, đảm bảo sử dụng thuốc an toàn, hiệu quả.
Quy định các biện pháp quản lý về giá để phù hợp với Luật Giá và biện pháp đặc thù trong quản lý giá thuốc là công bố, công bố lại giá bán buôn thuốc dự kiến áp dụng đối với thuốc kê đơn, bảo đảm việc bán buôn thuốc qua các tầng nấc trung gian không vượt qua giá bán buôn dự kiến đã được công bố../.
TTXVN